血液腫瘍ガイドライン2018が無料で読めます。
総合内科試験の山として読み込んだので紹介します。
まずは、多発性骨髄腫
http://www.jshem.or.jp/gui-hemali/3_1.html
多発性骨髄腫の治療指針もかなりアップデートされています。
古典的にはCRABと呼ばれる臓器障害を伴うというのが有名ですね、
C カルシウム(calcium)上昇
R 腎臓(renal)障害
A 貧血(anemia)
B 骨(bone)
これらの症状を認めない多発性骨髄腫は、くすぶり型と分類されます。
| Smouldering(Asymptomatic)multiple myeloma くすぶり型(無症候性)多発性骨髄腫 |
①血清中M蛋白(IgGまたはIgA型)≧3g/dLまたは尿中M蛋白≧500mg/24時間 ②クローナルな骨髄中形質細胞が10%以上で60%未満 ③myeloma defining events(MDE)*またはアミロイドーシスを認めない ①または②に加えて③を満たす |
|---|
全身化学療法の対象となるのはCRABのうち1つ以上を有している(症候性)多発性骨髄腫(symptomatic)multiple myelomaであり,M蛋白量は治療開始の指標としては用いないことに注意が必要とのことです。
くすぶり型多発性骨髄腫患者に対して診断後直ちに化学療法を実施することは,臓器障害発現時まで化学療法の開始を待つ戦略に比べて,生存期間の延長効果は認められず推奨されない。
症状が無くても2015年に改訂されたIMWG規準において,myeloma-defining biomarker(を有する場合も(症候性)多発性骨髄腫の範疇に含められたことも重要です。
これらは,従来のくすぶり型(無症候性)骨髄腫の中で2年以内に80%以上の確率で症候性骨髄腫に移行する可能性の高い病態とのことです。
myeloma-defining biomarkerは以下の通り。
| Myeloma-defining biomarkers** | 下記のバイオマーカー(biomarker)**の1つ以上を有する: ①骨髄中のクローナルな形質細胞 ≧60% ②involved/uninvolved FLC(血清遊離軽鎖)比≧100(involved FLC≧100mg/Lであること) ③MRIで2カ所以上の5mm以上の巣状骨病変あり |
|---|
BJPやM蛋白血症のイメージがどうしても強いですが、最近はフリーライトチェーンが診断においても重要視されています。
http://www.eiken.co.jp/modern_media/backnumber/pdf/MM1209_02.pdf

κ/λ 比率の異常で多発性骨髄腫をより鋭敏に見つける検査になり、さらに治療効果判定にも使えるとされています。
myeloma-defining biomarkerのみを有しMDE(CRAB症候)を示さない多発性骨髄腫の中には長期間進展しない患者も一部含まれており,日常診療においては直ちに治療開始すべきか注意深い経過観察を行うかは個別に判断することが望ましい。
診断基準の一覧は以下の通り
なお古典的は、IgM-MGUSは、
①血清中IgM型M蛋白<3g/dL
②骨髄中リンパ形質細胞浸潤<10%
③次の症候を欠如(貧血,全身症状,過粘稠,リンパ節腫大,肝脾腫とそれ以外の臓器障害)
①〜③のすべてを満たすものと定義されています。
表1 IMWGによる形質細胞腫瘍の診断規準
| Non-IgM MGUS 非IgM型意義不明の単クローン性ガンマグロブリン血症 |
①血清中非IgM型M蛋白<3g/dL ②クローナルな骨髄中形質細胞<10% ③臓器障害(CRABまたはアミロイドーシス)を認めない ①〜③のすべてを満たす |
|---|---|
| IgM MGUS IgM型意義不明の単クローン性ガンマグロブリン血症 |
①血清中IgM型M蛋白<3g/dL ②骨髄中リンパ形質細胞浸潤<10% ③次の症候を欠如(貧血,全身症状,過粘稠,リンパ節腫大,肝脾腫とそれ以外の臓器障害) ①〜③のすべてを満たす |
| Light-chain MGUS 軽鎖型意義不明の単クローン性ガンマグロブリン血症 |
①血清遊離軽鎖比の異常(<0.26または>1.65) ②該当する血清遊離軽鎖の増加 ③免疫固定法にて重鎖発現を認めない ④臓器障害(CRABまたはアミロイドーシス)を認めない ⑤クローナルな骨髄中形質細胞<10% ⑥尿中M蛋白量<500mg/24時間 ①〜⑥のすべてを満たす |
| Solitary plasmacytoma of bone/of soft tissue 孤立性形質細胞腫(骨の/軟部組織の) |
①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在 ②骨髄中にクローナルな形質細胞を認めない ③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない ④臓器障害(CRAB)を認めない ①〜④のすべてを満たす |
| Solitary plasmacytoma with minimal marrow involvement of bone/of soft tissue 微小骨髄浸潤を有する孤立性形質細胞腫(骨の/軟部組織の) |
①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在 ②骨髄中のクローナルな形質細胞<10% ③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない ④臓器障害(CRAB)を認めない ①〜④のすべてを満たす |
| Smouldering(Asymptomatic)multiple myeloma くすぶり型(無症候性)多発性骨髄腫 |
①血清中M蛋白(IgGまたはIgA型)≧3g/dLまたは尿中M蛋白≧500mg/24時間 ②クローナルな骨髄中形質細胞が10%以上で60%未満 ③myeloma defining events(MDE)*またはアミロイドーシスを認めない ①または②に加えて③を満たす |
| (Symptomatic)multiple myeloma secretary/non-secretary (症候性)多発性骨髄腫(分泌型/非分泌型) |
①クローナルな骨髄中形質細胞≧10%または生検にて診断された骨性または軟部組織の形質細胞腫を認める ②MDE*の1つ以上,またはbiomarker**の1つ以上を満たす ①と②の両者を満たす ①の骨髄中形質細胞が10%未満の場合は,2カ所以上の骨病変を認めることが必要 |
| Multiple solitary plasmacytoma 多発性形質細胞腫 |
①血清または尿中にM蛋白を検出しないか,検出しても微量である ②クローナルな形質細胞による2カ所以上の形質細胞腫または骨破壊を認める ③正常骨髄 ④形質細胞腫病変以外の骨所見に異常を認めない ⑤臓器障害(CRAB)を認めない ①〜⑤のすべてを満たす |
なお病気分類も重要です。
https://www.kotsuzuishu.jp/series01/03q02.html
古典的にはアルブミンとβ2ミクログロブリンを用いたISS分類が用いられていました。

最近ではそれに加えて、染色体異常とLDHを加えたR-ISSが使用されています。

R-ISS:
| Stage | 基準 | 5年生存割合 |
|---|---|---|
| Ⅰ | ISS stageⅠかつiFISHにてstandard-risk CAかつ 血清LDH正常範囲 |
82% |
| Ⅱ | R-ISS stageのⅠでもなくⅡでもない | 62% |
| Ⅲ | ISSⅢかつhigh-risk CAまたは血清LDH高値 | 40% |
(Palumbo A, et al. J Clin Oncol 33 : 2863-9, 2015より引用)
MGUS患者の進展リスクは以下の通りです。
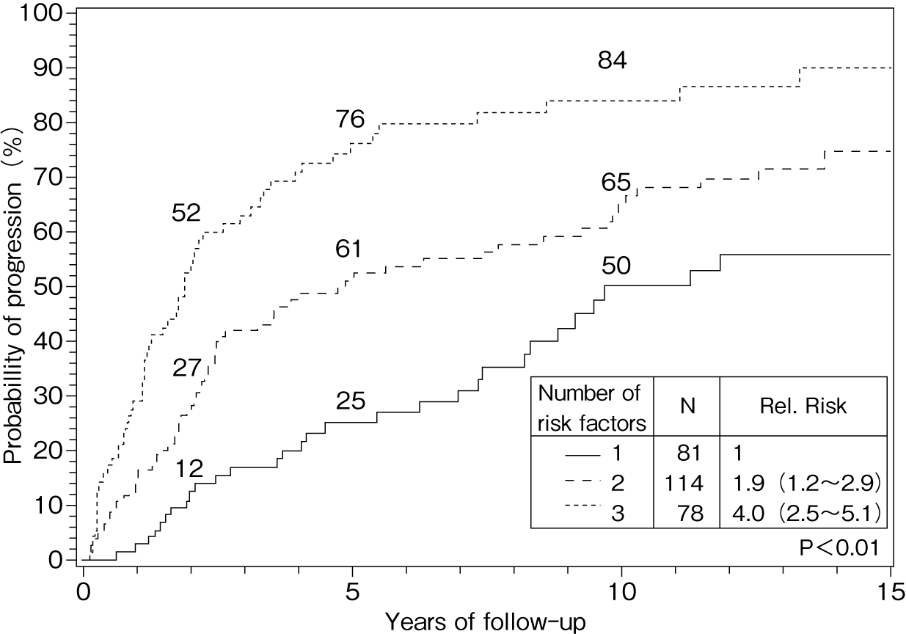
リスク因子:
骨髄中形質細胞割合≧10%,血清M蛋白濃度≧3g/dL,
血清遊離軽鎖比率の異常(κ/λ比:<0.125または>8.0)
では、治療はどうするか?
若年者など移植を前提とした治療です。
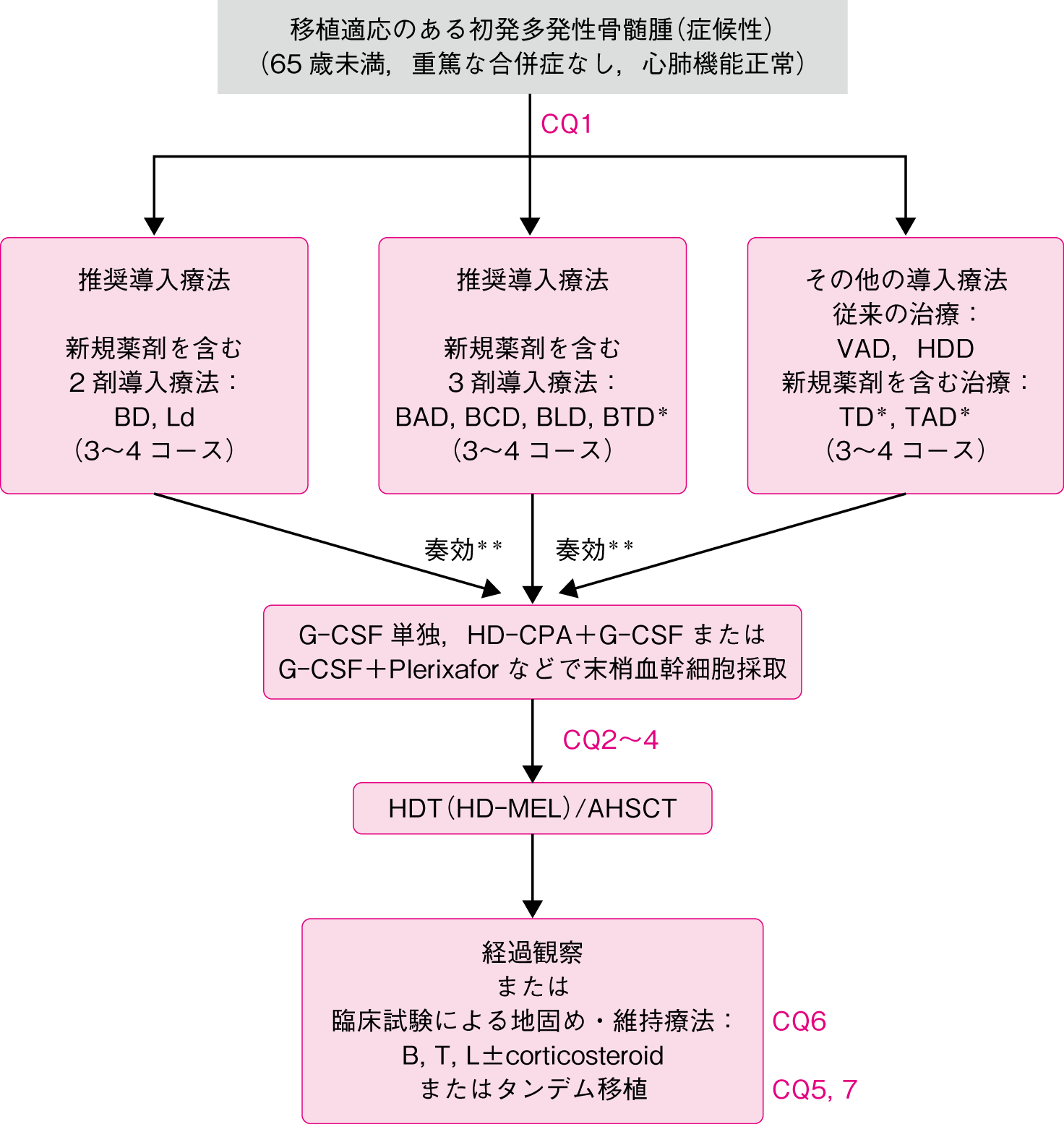
*国内保険適用外
**導入療法にて非奏効の場合は,導入療法の変更,あるいは再発・難治例に対する治療を選択
M(MEL): melphalan, P : prednisolone, B : bortezomib, T : thalidomide, L : lenalidomide,
C(CPA): cyclophosphamide, V : vincristine, A : doxorubicin, D : dexamethasone,
HDD : high-dose dexamethasone, d : low-dose dexamethasone, HDT : high-dose therapy,
AHSCT : autologous hematopoietic stem cell transplantation
多発性骨髄腫はMP療法というのが国家試験的なイメージでしたが、今は新規治療薬の時代です。
具体的には、サリドマイド誘導体であるレナリドミドとプロテアソーム阻害薬であるボルテゾミブの2トップの時代になっているようです。
CQ1 若年者症候性骨髄腫患者における移植を前提とした寛解導入療法では何が優れているか
- 推奨グレード
- カテゴリー1
移植を前提とした寛解導入療法としてボルテゾミブを含むレジメン,レナリドミドを含むレジメンが推奨される。
確かに、自分が研修医のころに新薬としてサリドマイドが使われ始めた気がします。
隔世の感がありますね。
レナリドミドは免疫調整役というカテゴリーですが、興味深いことに、5番染色体長腕部欠失を伴う骨髄異形成症候群、再発又は難治性の成人T細胞白血病リンパ腫にも使用されます。
上記のレジメも2トップのどちらか+デキサメタゾンという併用療法が基本になります。
3剤併用レジメとして、ボルテゾミブ(BOR)+レナリドミド(LEN)+デキサメタゾン(DEX)+というBLD療法というのもあるようです。
高齢などで移植非適応であっても2トップの地位は揺らぎません。
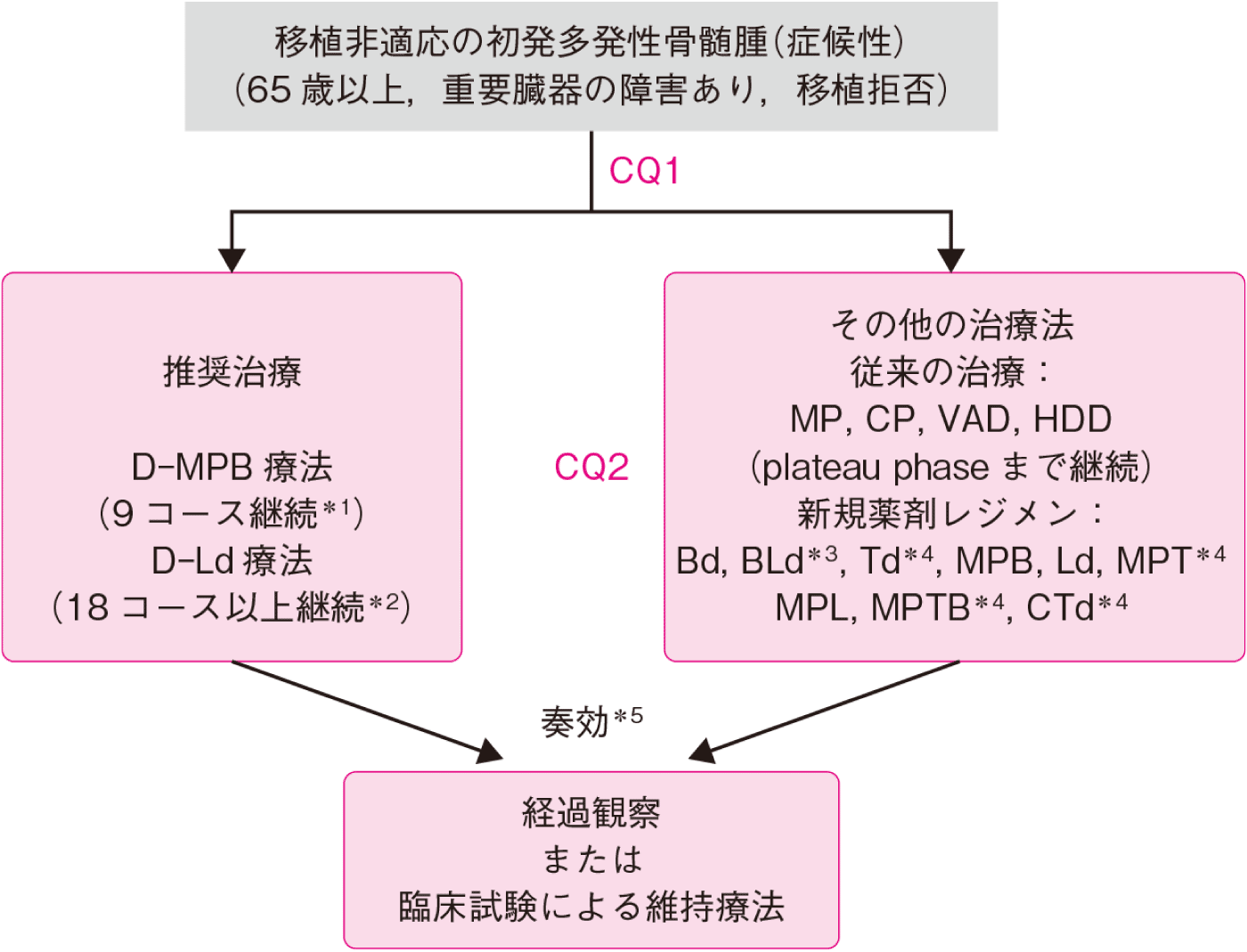
MPB療法(従来からあるMP療法+ボルテゾミブ)やレナリドミド+少量デキサメタゾンが移植非適応患者に対する標準治療として推奨されています。 これらは、40年以上にわたって標準治療であったMP療法(MEL, PSL)に比してPFSの延長効果のみでなくOSの延長効果も示されています。
【移植非適応の初発多発性骨髄腫(症候性)】
CQ1 移植非適応の多発性骨髄腫(症候性)に対する推奨治療レジメンは何か
- 推奨グレード
- カテゴリー1
新規薬剤を用いたMPB療法(メルファラン,プレドニゾロン,ボルテゾミブ)もしくは,Ld療法(レナリドミド,少量デキサメタゾン)が推奨される。患者の状態に応じてMPT療法(メルファラン,プレドニゾロン,サリドマイド),BLd lite療法(ボルテゾミブ,レナリドミド,少量デキサメタゾン),Bd療法や従来のMP療法を選択してもよい。
なお、再発例や難治例では抗体療法と新規治療薬の併用も推奨されているようです。
骨髄腫細胞に高発現しているsignaling lymphocytic activation molecule family member 7(SLAMF7)[別名CD2 subset 1(CS-1)]を認識するエロツズマブ(ELO)
CD38を認識するダラツムマブ(DARA)
の2種類が挙げられます。
CQ4 再発・難治性骨髄腫の治療に抗体療法は勧められるか
- 推奨グレード
- カテゴリー1
再発・難治性骨髄腫に対するエロツズマブ+レナリドミド+デキサメタゾン併用療法,ダラツムマブ+レナリドミド+デキサメタゾン併用療法,ダラツムマブ+ボルテゾミブ+デキサメタゾン療法は,それぞれ2剤療法と比較し無増悪生存期間を延長させるので推奨される。
なおプロテアーゼ阻害薬の副作用として帯状疱疹と深部静脈血栓症が挙げられ、それぞれアシクロビルとアスピリンによる予防内服が勧められています。
CQ3 プロテアソーム阻害薬投与中の患者に対するアシクロビル内服は帯状疱疹の発生率を減少させるか
- 推奨グレード
- カテゴリー2A
プロテアソーム阻害薬投与中の患者に対するアシクロビルの予防内服は帯状疱疹の発生率を減少させるため推奨される。
CQ4 免疫調節薬投与患者に対するアスピリンの内服は深部静脈血栓症の発生を抑制するか
- 推奨グレード
- カテゴリー2A
サリドマイド,レナリドミドやポマリドミドを含む併用療法では,低用量アスピリン(81〜100mg/日)の予防内服が深部静脈血栓症(DVT)発症の予防に推奨される。既存のDVT発症の危険因子を有する患者ではより厳格な管理が必要である。
骨病変を有する場合はデノスマブやゾレンドロン酸を使用しますが、顎骨壊死には十分に注意する必要があります。
CQ1 骨病変を有する患者に対して骨関連事象を減少させるための推奨治療は何か
- 推奨グレード
- カテゴリー1
骨病変を有する初発骨髄腫患者に対し治療開始時からのデノスマブあるいはゾレドロン酸の投与が推奨される。全生存割合への影響には両者の間で差はないが,デノスマブはゾレドロン酸に比べ無進行生存期間を延長させた。デノスマブは腎毒性が低いため,腎障害例ではデノスマブの投与がより推奨される。
CQ2 骨吸収抑制薬を投与する患者に対する口腔内予防処置は顎骨壊死の発生を抑制するか
- 推奨グレード
- カテゴリー2A
静脈注射用ビスホスホネートやデノスマブなどの骨吸収抑制薬の投与前に歯科医師による口腔内のチェックを受け必要な歯科処置をまず行い,投与開始後は口腔内ケアを行うとともに侵襲的歯科処置を避け,担当医の許可なく歯科治療を受けないようにすることにより,骨吸収抑制薬関連顎骨壊死(ARONJ)発生が抑制される。
以上、多発性骨髄腫のガイドラインですが国家試験受験時とは全然違いますね。
各領域のガイドラインに目を通すと、得るものが多いです。