
ホスピタリストの最新号が出ました。
市立奈良病院の勉強会をご紹介いただいた、関係で献本いただきました。
少し眺めましたが最新のエビデンスがギュッと詰まっていて、大変勉強になりそうです。
新規抗凝固薬のエビデンスも蓄積されてきているため、最新の知識を得るためには良い特集だと思います。
お勧めです!

https://www.nejm.org/doi/full/10.1056/NEJMoa1904143]
P 20歳以上の心房細動を合併した安定冠動脈疾患
冠動脈疾患の詳細は以下

⇒PCIやCABGをしていてこれ以上血行再建を必要としない患者。ステントが入っている患者も入っている。
●除外基準
ステント血栓、コントロール不良の高血圧、activeな悪性腫瘍は除外
I リバロキサバン単剤(腎機能で調整)
C リバロキサバン+抗血小板薬(アスピリン or P2Y 阻害薬)
O 脳卒中、全身塞栓症、心筋梗塞、血行再建を必要とする不安定狭心症、または何らかの原因による死亡。
日本の多施設の大規模RCT
Open labelであり現場では割付は分かっているが、解析者は割付を知らない
1:1にランダム化されベースラインは同等

ITT解析を行っている

サンプルサイズは足りている(非劣性で計算している)
●結果
少なくともリバロキサバン単剤であっても2剤併用療法と比べてアウトカムが悪くなることはない。
統計学的に有意に非劣性と言える。
Double blindではないので不安定狭心症による血行再建術は医師の主観が入る可能性があるが、あまり違いはない。
他は医師の主観が入りようがないhard outcome
出血は、明らかに2剤併用療法郡で多い結果


●まとめ
安定した心房細動合併冠動脈疾患はDOAC単剤投与でも問題なさそう。抗血小板療法の併用はむしろ出血などのアウトカムが増えるばかりではなく、死亡率も増える傾向があるかもしれない。
なお日本の下記のガイドラインでも以下のように心房細動合併したPCI症例のアルゴリズムが規定されている。


少なくともPCI後、1年経過すれば、DOAC単剤が望ましい。
今回は、治療についてです。
ガイドラインでも治療についてまとまっています。
まずはパーキソニズムを悪化させる薬について
下記の薬剤をパーキンソン病に悪化する場合は注意が必要です。


悪性症候群についても留意が必要です。
抗パーキンソン病薬を内服している場合は中断しないことが重要です。
特に抗精神病薬を投与する場合は注意しましょう。
疑えば十分な輸液、L-DOPAの投与を考慮します


そして、最も重要なことは手術や全身状態の悪化などがある場合にL-DOPAを中断しないということになります。

L-DOPA内服100㎎に対してL-DOPA点滴を50-100㎎と記載があります。
最もシンプルに考えればL-DOPA 100㎎1錠=ドパストン点滴50㎎1Aと覚えて、それに相当するドパストンを投与することが重要になります。
なおL-DOPAの量が少ない場合は、ドーパミンアゴニストの塗布剤や皮下注製剤への変更も考慮しても良いと記載があります。
確かにL-DOPAの点滴がハードルが高い場合には有効ですが、ドーパミンアゴニストは精神症状が出やすいので、非専門医はL-DOPAをまずは使うので良いかと思われます。
もちろん腸管が使えるなら経鼻チューブから同等量のL-DOPA内服を使用しても良いです。
妊婦の場合は基本、L-DOPAを使用するようです。

緩和ケアや終末期に対しても記載があります。

実際問題終末期と、難治性のパーキンソニズムで治療で良くなるかどうかの線引きはかなり難しいので、一度は専門科の意見は聞きたいところですね。
胃瘻などの代替栄養も悩ましいところですが、可能な限り患者本人の意向を尊重しつつ多職種で話すことが重要かと思われます。
北先生が市立奈良病院にいらっしゃって、講演をされました。
AMRについて改めて、勉強させて頂きました。
まずAWaRe分類について。
http://apps.who.int/medicinedocs/documents/s23413en/s23413en.pdf

抗菌薬を以下に分類します
Access 使用を勧める抗菌薬
Watch 限られた状況に限り使用する抗菌薬
Reserve 最後に温存する抗菌薬
の3パターンに分類します。
Accessの使用量を増やし、Watch,Reserveを可能な限り減らすことが重要になります
詳細は以下のリンクをご覧ください。
またAMRの達成目標としても経口セファロスポリン、フルオロキノロン、マクロライドの適正使用も重要です。
特に第3世代セフェム系の抗菌薬は吸収率も低すぎるため、臨床的に使用する状況はほぼないと言ってよいと思われます。
キノロンも耐性菌の比率が上がっているため、使用は控えるのが無難だと思われます。
例えば、膀胱炎ならセファレキシンで良いでしょうし、外来で治療できる腎盂腎炎ならST合剤も良いと思われます。
肺炎も軽症であれば、オーグメンチン/サワシリン+サワシリン(オグサワ)が無難かと思われます。
キノロンは可能な限り避けるほうが無難です。

抗菌薬の適正使用についても厚労省から手引きが出ています。
https://www.mhlw.go.jp/file/06-Seisakujouhou-10900000-Kenkoukyoku/0000166612.pdf
いわゆる、風邪には抗菌薬が不要と言うことがポイントです。
また副鼻腔炎や咽頭炎への抗菌薬も大概はサワシリンで対応が可能です。




抗菌薬はアナフィラキシーや薬疹のリスクもあり、感冒に対する抗菌薬処方は有害無益と言ってよいでしょう。
麻黄附子細辛湯は比較的使いやすくてお勧めです。
以下は、急性上気道感染の診療のフローチャートですが、とても分かりやすいです。

最近は抗菌薬が不足しているので、特に内服抗菌薬をうまく使用することが重要になると思われます。
特に、セファレキシン、サワシリン、オーグメンチン+サワシリン(オグサワ)、ST合剤に関しては使い方に精通するべきかと思います。
経口抗菌薬にスイッチするためにチェックする項目は以下のCOMSが挙げられますhttp://mikrobiologie.lf3.cuni.cz/nottces/Full%20Guidelines/iv%20switch%20policyupdate%20dec08_final.pdf
ただし、症例は選ぶ必要はあることに注意します。
詳細は以下の記事がまとまっているので、是非ご覧ください。
http://www.theidaten.jp/journal_cont/20190715J73-1.htm
最近は下記のような日本語のマニュアルも整備されてきているので、参考にすることも有効だと思われます。
まず診断基準です。
MDS診断基準が国際的なスタンダードですが、運動時緩慢がパーキソニズムとして必須となりました。
それにく加えて筋強剛、静止時振戦、姿勢保持障害のうち1つが認められること、左右差があること、L-DOPA反応性があることが加えられています。
特にL-DOPA反応性は今更ながら重要と言うことですね。この辺は実臨床の感覚にも合致します。

パーキンソン病は100人に1人がなると言われています。
実際にJAMAでパーキンソン病のパンデミックが起こると言われているくらいです。
下記のような検査がありますが、まずはきちんと病歴で疑い特徴的な身体診察で強く疑い脳神経内科に繋げることが極めて重要になります。
意外に見逃されている印象です。
下記の図が分かりやすいです。
以下、Junya Kawada先生のコメントより
「2015年MDS、2018年日本の基準では、ドパミン補充療法への反応に加え、医師が静止時振戦を確認する事、匂いの障害の有無又はMIBG心筋シンチH/M比の低下が重要となり、姿勢保持障害は問われなくなりました。」
姿勢保持障害は以前より重要視されなくなっているようですが、それでも重症度判定にはいまだに重要です。
http://parkinson-smile.net/symptom/p5.html
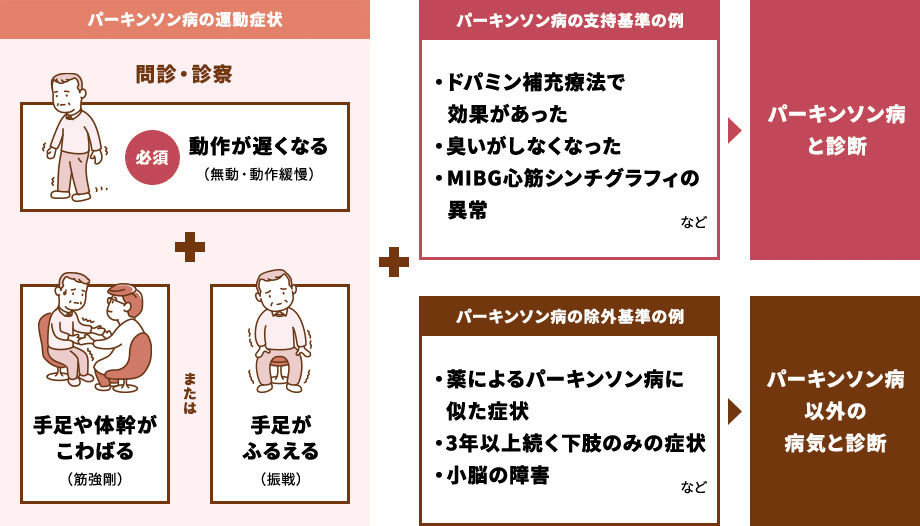
まずは病歴で、動きが遅くなったか、手が震えるか、歩くのが遅くなったかなど確認すると良いでしょう。
実際に歩行を診ることが極めて重要で、手の振りの低下、すり足歩行などを確認します。
下記の動画などを見ると良いでしょう。
https://www.youtube.com/watch?v=pFLC9C-xH8E
動作緩慢は他に指タップや腕回しで評価します。
特にパーキンソン病では左右差が出やすい傾向があります。
https://jamanetwork.com/journals/jama/article-abstract/195803

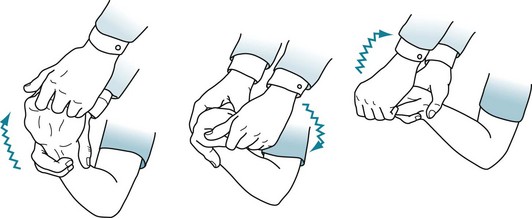
筋強剛は下記の画像のように他動的に手首や足首を動かして診察します。
肘や膝より手首や足首のほうが筋強剛は出やすいとされています。
https://clinicalgate.com/involuntary-movement-disorders/
静止時振戦はpill rolling tremorと言われ丸薬を丸めるような振戦です。
基本的には安静時に出現しますが、計算を行うなど精神的負荷をかけるとより出現しやすいとされています。
https://www.youtube.com/watch?v=e532YW-Zwf0
なおパーキンソン病の重症度分類は下記のホーン・ヤール分類を使用します
姿勢保持障害があるとⅢ度に分類され、特定疾患の助成対象になります。


嗅覚障害は実はパーキンソン病の診断に重要です。後述するPSP、CBD,脳血管性パーキンソニズムなどでは基本的に嗅覚は低下せず、MSAも嗅覚低下は軽度です。
パーキンソン病ではパーキンソニズム発症に先行して嗅覚低下することもあり、非常に重要な病歴と言えるでしょう。
次にMRIの役割についてです。あくまで除外診断という意味合いが強いです

ちなみにパーキンソン病の主な鑑別疾患は以下の6つです。
このうち下線を引いた疾患に関しては頭部MRIが診断に有効です。
もちろん、神経学的所見をきちんと取ることも重要です。
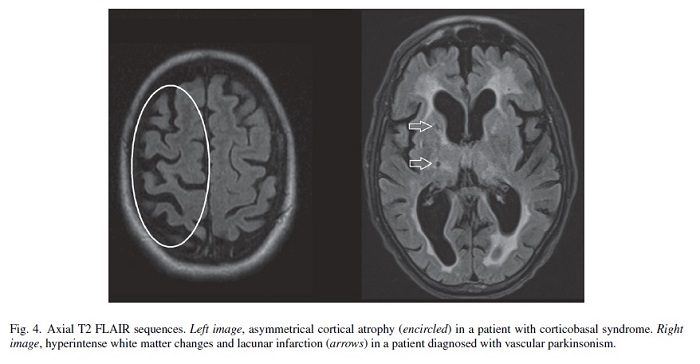
CBSでは著名な神経学的所見の左右差、失行を認めます。
それに伴い画像上も左右差が目立ちます。
http://www.ajnr.org/content/30/10/1884

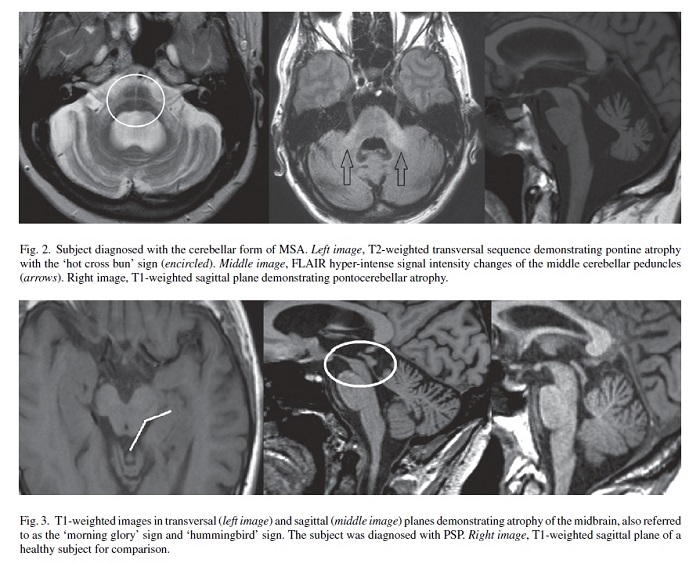
MSAでは小脳症状、強い自律神経症状(起立性低血圧)を認めます。
MSAはパーキンソン症状メインのMSA-Pと、小脳症状メインのMSA-Cに分類されます。
MSA-Cでは画像で小脳萎縮と橋底部の十字サインを認めます。

MSA-Pでは被殻外側スリット状高信号を認めます

PSPでは垂直性の眼球運動障害、頸部後屈、易転倒性を認め、特に階段を降りるときに転倒しやすいという特徴があります。
PSPでは下記のような特徴的な画像所見を認めます。いわゆるハミングバードサインです。http://www.jsnp.jp/pdf/cerebral_14.pdf

以下、MSAとPSPの画像所見です
脳血管性パーキソニズムは強い白質病変を画像上認め、階段状の進行、神経学的巣症状を伴います。
薬剤性パーキンソン病は当然、薬剤歴が重要ですが、特にスルピリド、抗精神病薬の頻度が高いです。
レビー小体型認知症はパーキンソン病とも合併するので厳密に分けることは難しいのですが、認知機能障害、幻視、易怒性、睡眠障害が前面に出やすいです。

パーキンソン病とその他のパーキンソン症候群を鑑別するのにMIBG心筋シンチも有用です。
これは筆者が研修医のころから既に使われていました。
パーキンソン病を含むレビー小体病では、心臓の交感神経の脱落・変性が起こるため、MIBGシンチの集積も低下します。

レビー小体型認知症や、3環形抗うつ薬、ラベタロールなどの薬剤でも低下することもあることに注意が必要です。

DATシンチもパーキンソン病の診断に有用とされています。
これは筆者が研修医のころはメジャーでなかったように思います。
ダットスキャンは、ドパミン神経の変性・脱落を画像化する診断技術とされています。
パーキンソン病など黒質線条体が変性する疾患では、ダットスキャンの集積が低下するため、本体性振戦や薬剤性パーキンソニズムなどの黒質線状体が変性しない疾患との鑑別に有用です。
ただし、PSPやMSAでも黒質線条体は変性するのでダットスキャンの集積は低下します。
nmp.co.jp/member/datscan/inpre/page03.h
http://zoketsushogaihan.com/file/guideline_H28/04.pdf
MDSについて。まずは参照ガイドから引用。
MDSは、1)無効造血、2)造血細胞の形態学的な異形成、3)末梢における血球減少、を特徴とする骨髄のクローン性腫瘍疾患であり、しばしば急性骨髄性白血病(acute myeloid leukemia: AML)へ移行するとされている。
MDSの病態は多岐にわたり、AMLや骨髄増殖性腫瘍(myeloproliferative neoplasm: MPN)などの腫瘍性疾患や再生不良性貧血(aplastic anemia: AA)などの骨髄不全症候群との鑑別が必要となるが、鑑別困難な症例もときに認められる。



一般に診断はWHO分類(2017)に基づき,血球減少,末梢血と骨髄の芽球割合,造血細胞の異形成,染色体異常によってなされます。

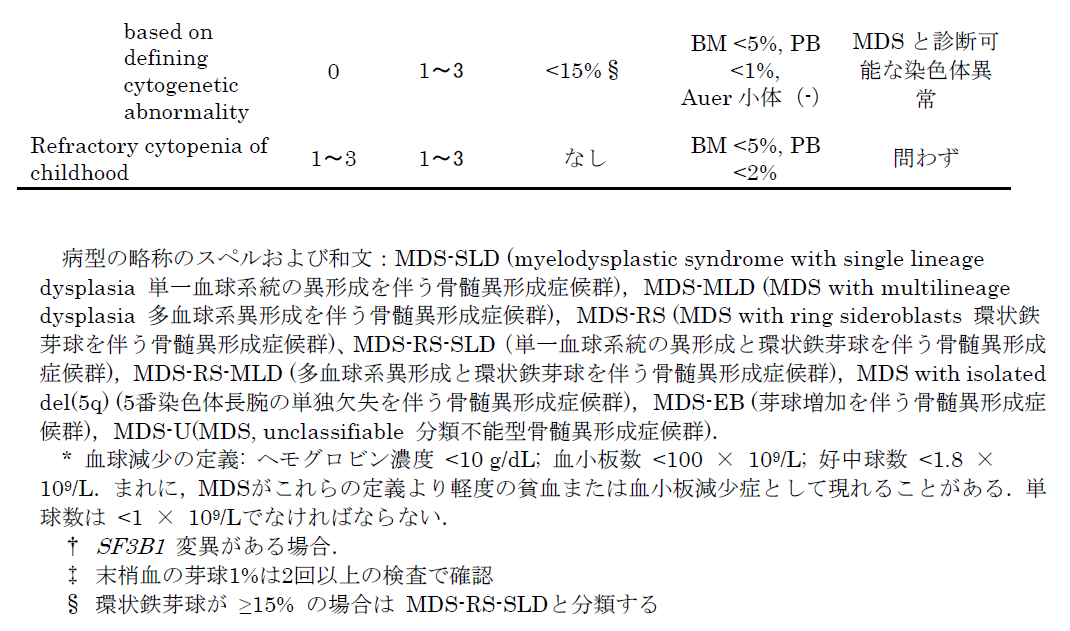
ではMDSのガイドラインを診ていきます。
http://www.jshem.or.jp/gui-hemali/1_6.html
国際予後予測スコアリングシステム(International Prognostic Scoring System:IPSS)やWHO分類に基づく予後予測スコアリングシステム(WHO Classification-based Prognostic Scoring System:WPSS),IPSSの改訂版である改訂国際予後予測スコアリングシステム(Revised IPSS:IPSS-R)のように複数の因子を組み合わせて予後を予測するスコアリングシステムが勧められる。特に,IPSSは頻用されており,近年IPSS-Rの利用が広がっている。
ポイントは予後予測には、IPSSよりも、IPSS-Rを最近は使用するということです。
IPSS-Rは染色体、芽球比率、Hb,血小板、好中球によってスコアリングします。
表3 IPSS-R 予後因子スコア
| 予後因子の配点 | 0 | 0.5 | 1 | 1.5 | 2 | 3 | 4 |
|---|---|---|---|---|---|---|---|
| 核型 (表5参照) |
Very Good | − | Good | − | Intermediate | Poor | Very poor |
| 骨髄芽球比率 (%) |
≦2 | − | >2〜<5 | − | 5〜10 | >10 | − |
| Hb(g/dL) | ≧10 | − | 8以上 10未満 |
<8 | − | − | − |
| 血小板数 (×103/μL) |
≧100 | 50〜<100 | <50 | − | − | − | − |
| 好中球数 (×103/μL) |
≧0.8 | <0.8 | − | − | − | − | − |
表4 IPSS-Rによる予後層別化
| リスク群 | 点数 |
|---|---|
| Very low | ≦1.5 |
| Low | >1.5〜3 |
| Intermediate | >3〜4.5 |
| High | >4.5〜6 |
| Very high | >6 |
染色体の核型によっても予後は変わってきます。
5番染色体長腕の中間欠失(del(5q)/5q-)を伴う症例は比較的均質な病像を示し,5q症候群と呼称されています。
5q症候群に関しては多発性骨髄腫の治療薬であるレナリドミドが効果的であり、特に覚えておくと良いかもしれません。
表5 IPSS-Rにおける染色体リスク群
| 予後グループ | 染色体核型 |
|---|---|
| Very good | -Y,del(11q) |
| Good | 正常,del(5q),del(12p),del(20q),double including del(5q) |
| Intermediate | del(7q),+8,+19,i(17q),any other single or double independent clones |
| Poor | -7 inv(3)/t(3q)/del(3q) double including -7/del(7q) complex:3 abnormalities |
| Very poor | Complex:>3 abnormalities |
一年以上など一定の予後が期待されかつ,定期的な赤血球輸血を必要とするMDSで,輸血による鉄過剰状態に至った場合には鉄キレート療法を実施する。
MDSでは輸血をすることも多くなりますが、輸血による鉄過剰にはキレート材が適応になります

では、治療です。基本的に低リスクか高リスクかに分けて考えます。

まずは低リスク郡への対応を考えます。
まず基本的なことですが、無症状の低リスク郡は経過観察を行います。
では症状がある場合はどうするか?以下の通りになります。
MDSの一部の症例に対しては造血の回復に免疫抑制療法が勧められる。特にHLA-DR15,赤血球輸血歴の短い例,若年例での効果が期待される(国内保険適用外)。
再生不良性貧血と同様に免疫抑制療法が考慮されます。
血清エリスロポエチン濃度低値(200または500mU/mL未満),環状鉄芽球15%未満,赤血球輸血依存のないまたは月2単位程度の 輸血を必要とする貧血を有するMDSに対してはエリスロポエチン(40,000〜60,000U週1〜3回投与)あるいはダルベポエチン(150〜500μg週1〜3回投与)の投与が貧血を改善させる。ダルベポエチンはMDSに伴う貧血に対して保険適用となっている。顆粒球コロニー刺激因子(G-CSF)の併用はESA製剤への反応性を上昇させるが,ダルベポエチンの効果増強を目的としたG-CSFの使用は本邦では保険適用となっていない。
エリスロポエチン、ダルベポエチンも使うことがあるようです。
5番染色体長腕の欠失[del(5q)]を伴う低リスクMDSで赤血球輸血依存例に対してはレナリドミドが赤血球造血促進効果を示し,レナリドミドによる治療が推奨される。10mg/日の21日間投与を28日サイクルで実施する。
低リスクでも5q症候群ではレナリドミドが推奨されます。
では、高リスク郡ではどうでしょうか?
基本的に若年者で同種造血幹細胞移植が可能なら可及的速やかに行います。
高リスクMDS患者では,できる限り速やかに同種造血幹細胞移植を行う。HLA 1座不適合以内の血縁者間移植が最も望ましいが,血縁ドナーが得られない場合は,HLA一致非血縁者間移植も考慮する。
ただMDSは高齢者で多いことを考えると現実的に移植が出来ない症例が多いと思われます。
移植できない高リスクMDSはアザシチジンが勧められます。
アザシチジンは,同種造血幹細胞移植が行われない高リスク症例では第一選択薬剤である。
生存期間,白血病化までの期間を延長する化学療法の報告はなく,第一選択としては推奨されない(アザシチジンが推奨される)
レナリドミドも高リスクMDSであっても、5q症候群では使用を考慮します。
del(5q)を有する高リスクMDSにおいては,アザシチジン不応あるいは不耐の場合,レナリドミドの使用を考慮しても良い。
アザシチジンは筆者が学生の頃はMDSの標準治療薬ではなかったと思います。
2011年発売ですから、筆者が初期研修医2年目の頃ですね。
https://medical.nikkeibp.co.jp/leaf/all/series/drug/update/201103/518936.html
初期研修医1年目の先生に聞くと、普通に国家試験に出題されると。
常にアップデートしないとだめですね。
日本語のガイドラインも今更ですが、勉強になります。
ちなみにアザシチジンの代表的なRCTは以下
https://www.ncbi.nlm.nih.gov/pubmed/19230772
P 高リスクの骨髄異形成症候群(主としてFAB分類のRAEB、RAEB-t、CMMoL)
I アザシチジン(アザシチジン:75mg/sqを1日1回7日間皮下投与し、3週間休薬する。これを1サイクルとし、投与を繰り返した。疾患の増悪や治療継続困難な有害事象の発現が認められない限り投与継続可能とした。最低6サイクルを目標とした。)
C 通常治療法(支持療法、少量シタラビン療法、標準化学療法)
O 生存率


Blindはされていないが、明らかにhard outdomeを改善している。
確かに、第1選択薬となってしかるべきか。。
血液腫瘍ガイドライン2018が無料で読めます。
総合内科試験の山として読み込んだので紹介します。
まずは、多発性骨髄腫
http://www.jshem.or.jp/gui-hemali/3_1.html
多発性骨髄腫の治療指針もかなりアップデートされています。
古典的にはCRABと呼ばれる臓器障害を伴うというのが有名ですね、
C カルシウム(calcium)上昇
R 腎臓(renal)障害
A 貧血(anemia)
B 骨(bone)
これらの症状を認めない多発性骨髄腫は、くすぶり型と分類されます。
| Smouldering(Asymptomatic)multiple myeloma くすぶり型(無症候性)多発性骨髄腫 |
①血清中M蛋白(IgGまたはIgA型)≧3g/dLまたは尿中M蛋白≧500mg/24時間 ②クローナルな骨髄中形質細胞が10%以上で60%未満 ③myeloma defining events(MDE)*またはアミロイドーシスを認めない ①または②に加えて③を満たす |
|---|
全身化学療法の対象となるのはCRABのうち1つ以上を有している(症候性)多発性骨髄腫(symptomatic)multiple myelomaであり,M蛋白量は治療開始の指標としては用いないことに注意が必要とのことです。
くすぶり型多発性骨髄腫患者に対して診断後直ちに化学療法を実施することは,臓器障害発現時まで化学療法の開始を待つ戦略に比べて,生存期間の延長効果は認められず推奨されない。
症状が無くても2015年に改訂されたIMWG規準において,myeloma-defining biomarker(を有する場合も(症候性)多発性骨髄腫の範疇に含められたことも重要です。
これらは,従来のくすぶり型(無症候性)骨髄腫の中で2年以内に80%以上の確率で症候性骨髄腫に移行する可能性の高い病態とのことです。
myeloma-defining biomarkerは以下の通り。
| Myeloma-defining biomarkers** | 下記のバイオマーカー(biomarker)**の1つ以上を有する: ①骨髄中のクローナルな形質細胞 ≧60% ②involved/uninvolved FLC(血清遊離軽鎖)比≧100(involved FLC≧100mg/Lであること) ③MRIで2カ所以上の5mm以上の巣状骨病変あり |
|---|
BJPやM蛋白血症のイメージがどうしても強いですが、最近はフリーライトチェーンが診断においても重要視されています。
http://www.eiken.co.jp/modern_media/backnumber/pdf/MM1209_02.pdf

κ/λ 比率の異常で多発性骨髄腫をより鋭敏に見つける検査になり、さらに治療効果判定にも使えるとされています。
myeloma-defining biomarkerのみを有しMDE(CRAB症候)を示さない多発性骨髄腫の中には長期間進展しない患者も一部含まれており,日常診療においては直ちに治療開始すべきか注意深い経過観察を行うかは個別に判断することが望ましい。
診断基準の一覧は以下の通り
なお古典的は、IgM-MGUSは、
①血清中IgM型M蛋白<3g/dL
②骨髄中リンパ形質細胞浸潤<10%
③次の症候を欠如(貧血,全身症状,過粘稠,リンパ節腫大,肝脾腫とそれ以外の臓器障害)
①〜③のすべてを満たすものと定義されています。
表1 IMWGによる形質細胞腫瘍の診断規準
| Non-IgM MGUS 非IgM型意義不明の単クローン性ガンマグロブリン血症 |
①血清中非IgM型M蛋白<3g/dL ②クローナルな骨髄中形質細胞<10% ③臓器障害(CRABまたはアミロイドーシス)を認めない ①〜③のすべてを満たす |
|---|---|
| IgM MGUS IgM型意義不明の単クローン性ガンマグロブリン血症 |
①血清中IgM型M蛋白<3g/dL ②骨髄中リンパ形質細胞浸潤<10% ③次の症候を欠如(貧血,全身症状,過粘稠,リンパ節腫大,肝脾腫とそれ以外の臓器障害) ①〜③のすべてを満たす |
| Light-chain MGUS 軽鎖型意義不明の単クローン性ガンマグロブリン血症 |
①血清遊離軽鎖比の異常(<0.26または>1.65) ②該当する血清遊離軽鎖の増加 ③免疫固定法にて重鎖発現を認めない ④臓器障害(CRABまたはアミロイドーシス)を認めない ⑤クローナルな骨髄中形質細胞<10% ⑥尿中M蛋白量<500mg/24時間 ①〜⑥のすべてを満たす |
| Solitary plasmacytoma of bone/of soft tissue 孤立性形質細胞腫(骨の/軟部組織の) |
①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在 ②骨髄中にクローナルな形質細胞を認めない ③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない ④臓器障害(CRAB)を認めない ①〜④のすべてを満たす |
| Solitary plasmacytoma with minimal marrow involvement of bone/of soft tissue 微小骨髄浸潤を有する孤立性形質細胞腫(骨の/軟部組織の) |
①生検にてクローナルな形質細胞から成る骨あるいは軟部組織の形質細胞腫の存在 ②骨髄中のクローナルな形質細胞<10% ③孤立性形質細胞腫病変以外には骨X線,椎体および骨盤MRI(またはCT)で異常を認めない ④臓器障害(CRAB)を認めない ①〜④のすべてを満たす |
| Smouldering(Asymptomatic)multiple myeloma くすぶり型(無症候性)多発性骨髄腫 |
①血清中M蛋白(IgGまたはIgA型)≧3g/dLまたは尿中M蛋白≧500mg/24時間 ②クローナルな骨髄中形質細胞が10%以上で60%未満 ③myeloma defining events(MDE)*またはアミロイドーシスを認めない ①または②に加えて③を満たす |
| (Symptomatic)multiple myeloma secretary/non-secretary (症候性)多発性骨髄腫(分泌型/非分泌型) |
①クローナルな骨髄中形質細胞≧10%または生検にて診断された骨性または軟部組織の形質細胞腫を認める ②MDE*の1つ以上,またはbiomarker**の1つ以上を満たす ①と②の両者を満たす ①の骨髄中形質細胞が10%未満の場合は,2カ所以上の骨病変を認めることが必要 |
| Multiple solitary plasmacytoma 多発性形質細胞腫 |
①血清または尿中にM蛋白を検出しないか,検出しても微量である ②クローナルな形質細胞による2カ所以上の形質細胞腫または骨破壊を認める ③正常骨髄 ④形質細胞腫病変以外の骨所見に異常を認めない ⑤臓器障害(CRAB)を認めない ①〜⑤のすべてを満たす |
なお病気分類も重要です。
https://www.kotsuzuishu.jp/series01/03q02.html
古典的にはアルブミンとβ2ミクログロブリンを用いたISS分類が用いられていました。

最近ではそれに加えて、染色体異常とLDHを加えたR-ISSが使用されています。

R-ISS:
| Stage | 基準 | 5年生存割合 |
|---|---|---|
| Ⅰ | ISS stageⅠかつiFISHにてstandard-risk CAかつ 血清LDH正常範囲 |
82% |
| Ⅱ | R-ISS stageのⅠでもなくⅡでもない | 62% |
| Ⅲ | ISSⅢかつhigh-risk CAまたは血清LDH高値 | 40% |
(Palumbo A, et al. J Clin Oncol 33 : 2863-9, 2015より引用)
MGUS患者の進展リスクは以下の通りです。
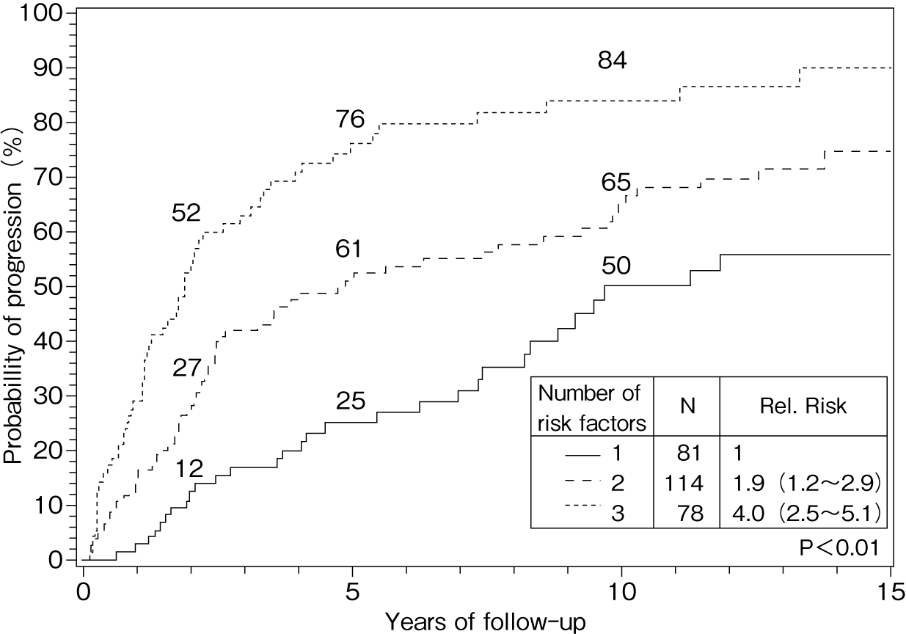
リスク因子:
骨髄中形質細胞割合≧10%,血清M蛋白濃度≧3g/dL,
血清遊離軽鎖比率の異常(κ/λ比:<0.125または>8.0)
では、治療はどうするか?
若年者など移植を前提とした治療です。
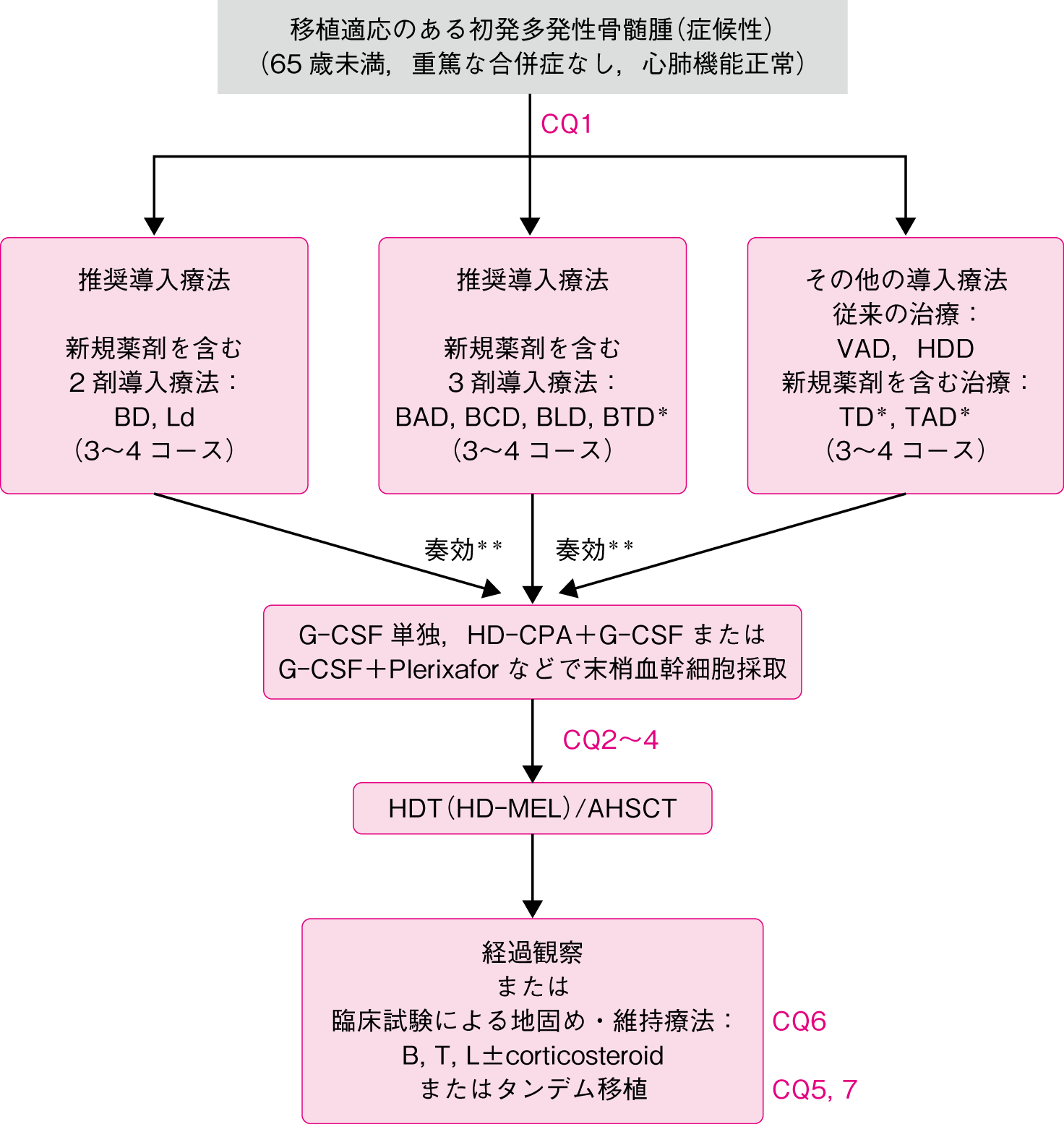
*国内保険適用外
**導入療法にて非奏効の場合は,導入療法の変更,あるいは再発・難治例に対する治療を選択
M(MEL): melphalan, P : prednisolone, B : bortezomib, T : thalidomide, L : lenalidomide,
C(CPA): cyclophosphamide, V : vincristine, A : doxorubicin, D : dexamethasone,
HDD : high-dose dexamethasone, d : low-dose dexamethasone, HDT : high-dose therapy,
AHSCT : autologous hematopoietic stem cell transplantation
多発性骨髄腫はMP療法というのが国家試験的なイメージでしたが、今は新規治療薬の時代です。
具体的には、サリドマイド誘導体であるレナリドミドとプロテアソーム阻害薬であるボルテゾミブの2トップの時代になっているようです。
移植を前提とした寛解導入療法としてボルテゾミブを含むレジメン,レナリドミドを含むレジメンが推奨される。
確かに、自分が研修医のころに新薬としてサリドマイドが使われ始めた気がします。
隔世の感がありますね。
レナリドミドは免疫調整役というカテゴリーですが、興味深いことに、5番染色体長腕部欠失を伴う骨髄異形成症候群、再発又は難治性の成人T細胞白血病リンパ腫にも使用されます。
上記のレジメも2トップのどちらか+デキサメタゾンという併用療法が基本になります。
3剤併用レジメとして、ボルテゾミブ(BOR)+レナリドミド(LEN)+デキサメタゾン(DEX)+というBLD療法というのもあるようです。
高齢などで移植非適応であっても2トップの地位は揺らぎません。
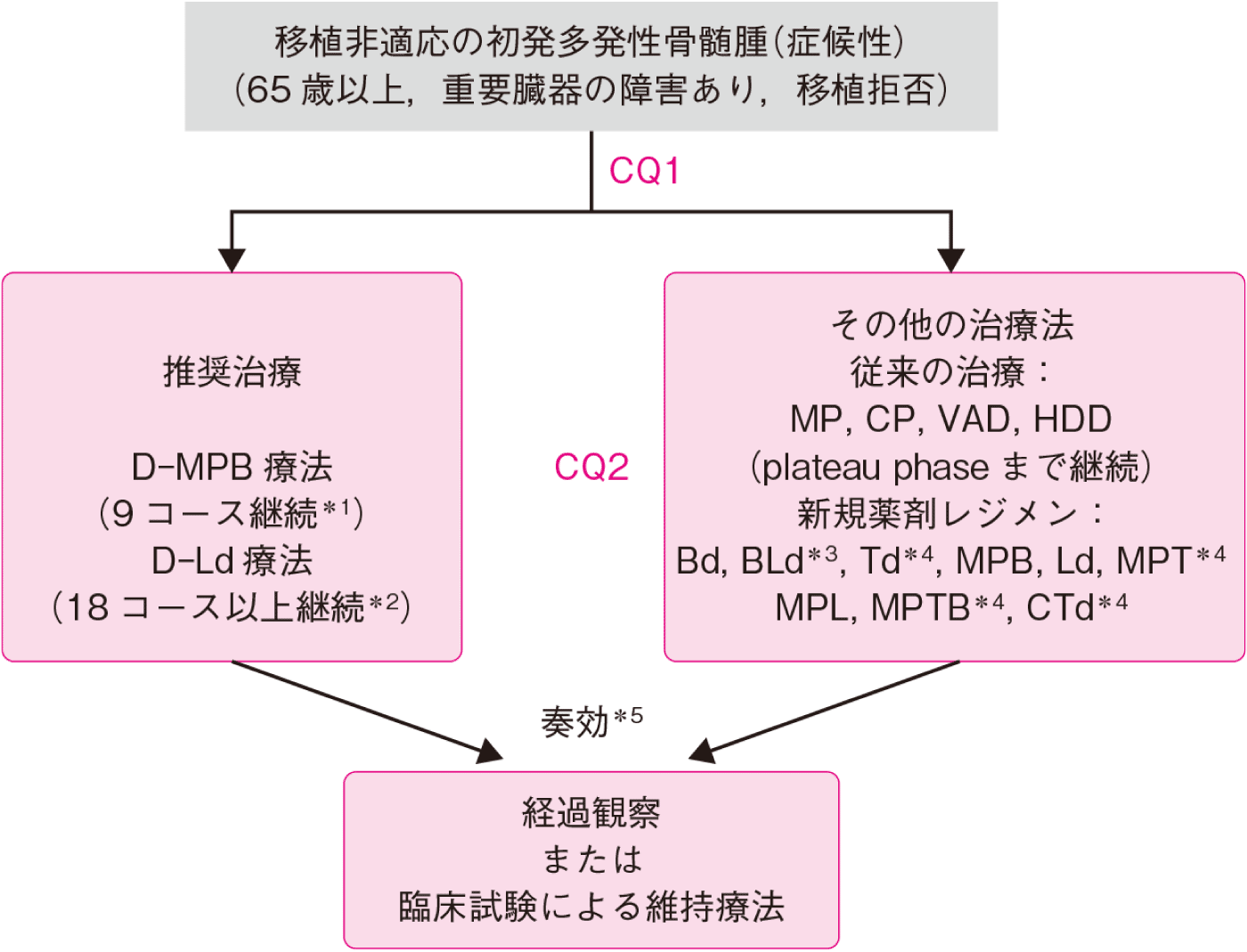
MPB療法(従来からあるMP療法+ボルテゾミブ)やレナリドミド+少量デキサメタゾンが移植非適応患者に対する標準治療として推奨されています。 これらは、40年以上にわたって標準治療であったMP療法(MEL, PSL)に比してPFSの延長効果のみでなくOSの延長効果も示されています。
新規薬剤を用いたMPB療法(メルファラン,プレドニゾロン,ボルテゾミブ)もしくは,Ld療法(レナリドミド,少量デキサメタゾン)が推奨される。患者の状態に応じてMPT療法(メルファラン,プレドニゾロン,サリドマイド),BLd lite療法(ボルテゾミブ,レナリドミド,少量デキサメタゾン),Bd療法や従来のMP療法を選択してもよい。
なお、再発例や難治例では抗体療法と新規治療薬の併用も推奨されているようです。
骨髄腫細胞に高発現しているsignaling lymphocytic activation molecule family member 7(SLAMF7)[別名CD2 subset 1(CS-1)]を認識するエロツズマブ(ELO)
CD38を認識するダラツムマブ(DARA)
の2種類が挙げられます。
再発・難治性骨髄腫に対するエロツズマブ+レナリドミド+デキサメタゾン併用療法,ダラツムマブ+レナリドミド+デキサメタゾン併用療法,ダラツムマブ+ボルテゾミブ+デキサメタゾン療法は,それぞれ2剤療法と比較し無増悪生存期間を延長させるので推奨される。
なおプロテアーゼ阻害薬の副作用として帯状疱疹と深部静脈血栓症が挙げられ、それぞれアシクロビルとアスピリンによる予防内服が勧められています。
プロテアソーム阻害薬投与中の患者に対するアシクロビルの予防内服は帯状疱疹の発生率を減少させるため推奨される。
サリドマイド,レナリドミドやポマリドミドを含む併用療法では,低用量アスピリン(81〜100mg/日)の予防内服が深部静脈血栓症(DVT)発症の予防に推奨される。既存のDVT発症の危険因子を有する患者ではより厳格な管理が必要である。
骨病変を有する場合はデノスマブやゾレンドロン酸を使用しますが、顎骨壊死には十分に注意する必要があります。
骨病変を有する初発骨髄腫患者に対し治療開始時からのデノスマブあるいはゾレドロン酸の投与が推奨される。全生存割合への影響には両者の間で差はないが,デノスマブはゾレドロン酸に比べ無進行生存期間を延長させた。デノスマブは腎毒性が低いため,腎障害例ではデノスマブの投与がより推奨される。
静脈注射用ビスホスホネートやデノスマブなどの骨吸収抑制薬の投与前に歯科医師による口腔内のチェックを受け必要な歯科処置をまず行い,投与開始後は口腔内ケアを行うとともに侵襲的歯科処置を避け,担当医の許可なく歯科治療を受けないようにすることにより,骨吸収抑制薬関連顎骨壊死(ARONJ)発生が抑制される。
以上、多発性骨髄腫のガイドラインですが国家試験受験時とは全然違いますね。
各領域のガイドラインに目を通すと、得るものが多いです。