http://zoketsushogaihan.com/file/guideline_H28/04.pdf
MDSについて。まずは参照ガイドから引用。
MDSは、1)無効造血、2)造血細胞の形態学的な異形成、3)末梢における血球減少、を特徴とする骨髄のクローン性腫瘍疾患であり、しばしば急性骨髄性白血病(acute myeloid leukemia: AML)へ移行するとされている。
MDSの病態は多岐にわたり、AMLや骨髄増殖性腫瘍(myeloproliferative neoplasm: MPN)などの腫瘍性疾患や再生不良性貧血(aplastic anemia: AA)などの骨髄不全症候群との鑑別が必要となるが、鑑別困難な症例もときに認められる。



一般に診断はWHO分類(2017)に基づき,血球減少,末梢血と骨髄の芽球割合,造血細胞の異形成,染色体異常によってなされます。

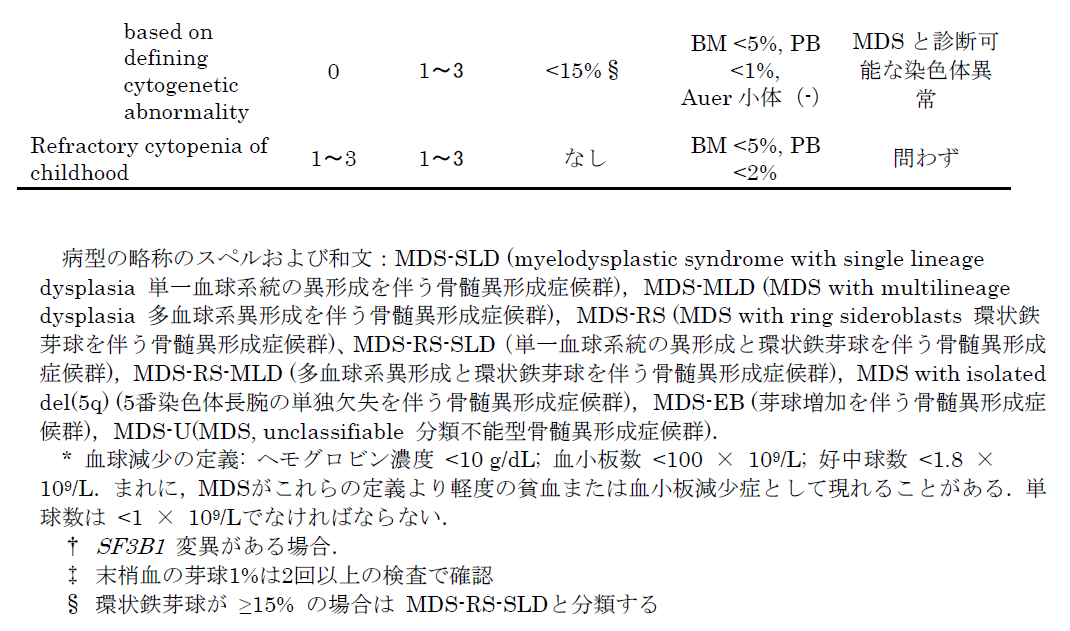
ではMDSのガイドラインを診ていきます。
http://www.jshem.or.jp/gui-hemali/1_6.html
CQ1 MDSの予後予測法,リスク分類として勧められるのは何か
- 推奨グレード
- カテゴリー2A
国際予後予測スコアリングシステム(International Prognostic Scoring System:IPSS)やWHO分類に基づく予後予測スコアリングシステム(WHO Classification-based Prognostic Scoring System:WPSS),IPSSの改訂版である改訂国際予後予測スコアリングシステム(Revised IPSS:IPSS-R)のように複数の因子を組み合わせて予後を予測するスコアリングシステムが勧められる。特に,IPSSは頻用されており,近年IPSS-Rの利用が広がっている。
ポイントは予後予測には、IPSSよりも、IPSS-Rを最近は使用するということです。
IPSS-Rは染色体、芽球比率、Hb,血小板、好中球によってスコアリングします。
表3 IPSS-R 予後因子スコア
| 予後因子の配点 | 0 | 0.5 | 1 | 1.5 | 2 | 3 | 4 |
|---|---|---|---|---|---|---|---|
| 核型 (表5参照) |
Very Good | − | Good | − | Intermediate | Poor | Very poor |
| 骨髄芽球比率 (%) |
≦2 | − | >2〜<5 | − | 5〜10 | >10 | − |
| Hb(g/dL) | ≧10 | − | 8以上 10未満 |
<8 | − | − | − |
| 血小板数 (×103/μL) |
≧100 | 50〜<100 | <50 | − | − | − | − |
| 好中球数 (×103/μL) |
≧0.8 | <0.8 | − | − | − | − | − |
表4 IPSS-Rによる予後層別化
| リスク群 | 点数 |
|---|---|
| Very low | ≦1.5 |
| Low | >1.5〜3 |
| Intermediate | >3〜4.5 |
| High | >4.5〜6 |
| Very high | >6 |
染色体の核型によっても予後は変わってきます。
5番染色体長腕の中間欠失(del(5q)/5q-)を伴う症例は比較的均質な病像を示し,5q症候群と呼称されています。
5q症候群に関しては多発性骨髄腫の治療薬であるレナリドミドが効果的であり、特に覚えておくと良いかもしれません。
表5 IPSS-Rにおける染色体リスク群
| 予後グループ | 染色体核型 |
|---|---|
| Very good | -Y,del(11q) |
| Good | 正常,del(5q),del(12p),del(20q),double including del(5q) |
| Intermediate | del(7q),+8,+19,i(17q),any other single or double independent clones |
| Poor | -7 inv(3)/t(3q)/del(3q) double including -7/del(7q) complex:3 abnormalities |
| Very poor | Complex:>3 abnormalities |
CQ2 輸血による鉄過剰症への鉄キレート剤が適応とされる状態は何か
- 推奨グレード
- カテゴリー2B
一年以上など一定の予後が期待されかつ,定期的な赤血球輸血を必要とするMDSで,輸血による鉄過剰状態に至った場合には鉄キレート療法を実施する。
MDSでは輸血をすることも多くなりますが、輸血による鉄過剰にはキレート材が適応になります

では、治療です。基本的に低リスクか高リスクかに分けて考えます。

まずは低リスク郡への対応を考えます。
まず基本的なことですが、無症状の低リスク郡は経過観察を行います。
では症状がある場合はどうするか?以下の通りになります。
CQ3 低リスクMDSの治療において免疫抑制療法は勧められるか
- 推奨グレード
- カテゴリー2A
MDSの一部の症例に対しては造血の回復に免疫抑制療法が勧められる。特にHLA-DR15,赤血球輸血歴の短い例,若年例での効果が期待される(国内保険適用外)。
再生不良性貧血と同様に免疫抑制療法が考慮されます。
CQ4 低リスクMDSの貧血に対してサイトカイン療法は勧められるか
- 推奨グレード
- カテゴリー2A
血清エリスロポエチン濃度低値(200または500mU/mL未満),環状鉄芽球15%未満,赤血球輸血依存のないまたは月2単位程度の 輸血を必要とする貧血を有するMDSに対してはエリスロポエチン(40,000〜60,000U週1〜3回投与)あるいはダルベポエチン(150〜500μg週1〜3回投与)の投与が貧血を改善させる。ダルベポエチンはMDSに伴う貧血に対して保険適用となっている。顆粒球コロニー刺激因子(G-CSF)の併用はESA製剤への反応性を上昇させるが,ダルベポエチンの効果増強を目的としたG-CSFの使用は本邦では保険適用となっていない。
エリスロポエチン、ダルベポエチンも使うことがあるようです。
CQ6 MDSの治療としてレナリドミドは勧められるか
- 推奨グレード
- カテゴリー1
5番染色体長腕の欠失[del(5q)]を伴う低リスクMDSで赤血球輸血依存例に対してはレナリドミドが赤血球造血促進効果を示し,レナリドミドによる治療が推奨される。10mg/日の21日間投与を28日サイクルで実施する。
低リスクでも5q症候群ではレナリドミドが推奨されます。
では、高リスク郡ではどうでしょうか?
基本的に若年者で同種造血幹細胞移植が可能なら可及的速やかに行います。
CQ8 MDSに対する同種造血幹細胞移植の適応と適切な実施時期はいつか
- 推奨グレード
- カテゴリー2A
高リスクMDS患者では,できる限り速やかに同種造血幹細胞移植を行う。HLA 1座不適合以内の血縁者間移植が最も望ましいが,血縁ドナーが得られない場合は,HLA一致非血縁者間移植も考慮する。
ただMDSは高齢者で多いことを考えると現実的に移植が出来ない症例が多いと思われます。
移植できない高リスクMDSはアザシチジンが勧められます。
CQ10 高リスクMDSに対してアザシチジンは勧められるか
- 推奨グレード
- カテゴリー1
アザシチジンは,同種造血幹細胞移植が行われない高リスク症例では第一選択薬剤である。
CQ12 高リスクMDSにおいて化学療法は勧められるか
- 推奨グレード
- カテゴリー2A
生存期間,白血病化までの期間を延長する化学療法の報告はなく,第一選択としては推奨されない(アザシチジンが推奨される)
レナリドミドも高リスクMDSであっても、5q症候群では使用を考慮します。
CQ11 高リスクMDSに対してレナリドミドは勧められるか
- 推奨グレード
- カテゴリー2B
del(5q)を有する高リスクMDSにおいては,アザシチジン不応あるいは不耐の場合,レナリドミドの使用を考慮しても良い。
アザシチジンは筆者が学生の頃はMDSの標準治療薬ではなかったと思います。
2011年発売ですから、筆者が初期研修医2年目の頃ですね。
https://medical.nikkeibp.co.jp/leaf/all/series/drug/update/201103/518936.html
初期研修医1年目の先生に聞くと、普通に国家試験に出題されると。
常にアップデートしないとだめですね。
日本語のガイドラインも今更ですが、勉強になります。
ちなみにアザシチジンの代表的なRCTは以下
https://www.ncbi.nlm.nih.gov/pubmed/19230772
P 高リスクの骨髄異形成症候群(主としてFAB分類のRAEB、RAEB-t、CMMoL)
I アザシチジン(アザシチジン:75mg/sqを1日1回7日間皮下投与し、3週間休薬する。これを1サイクルとし、投与を繰り返した。疾患の増悪や治療継続困難な有害事象の発現が認められない限り投与継続可能とした。最低6サイクルを目標とした。)
C 通常治療法(支持療法、少量シタラビン療法、標準化学療法)
O 生存率


Blindはされていないが、明らかにhard outdomeを改善している。
確かに、第1選択薬となってしかるべきか。。